白菜官网肖仕课题组在植物自噬起始调控机理研究中取得新进展
细胞自噬是真核生物维持细胞内环境稳态、保障营养能量持续供给的关键生物学过程,在调控细胞生长发育、生物和非生物逆境响应中发挥重要作用。细胞在营养能量缺乏时诱导自噬发生,这一过程受到一系列自噬相关蛋白(ATGs)的高度调控。其中,蛋白激酶ATG1和ATG13在自噬诱导时被激活,形成一个ATG1-ATG13蛋白激酶复合物,从而启动自噬体的形成。近年来,泛素-蛋白酶体介导自噬相关蛋白稳定性调控自噬体形成通路的研究取得了重要进展,但是迄今为止,对于自噬蛋白的磷酸化和泛素化的交互调控机制还不清楚。
肖仕教授课题组通过分子遗传学和生物化学分析,发现接头分子14-3-3λ和14-3-3κ与自噬蛋白激酶复合体成员ATG1-ATG13和E3泛素连接酶SINATs等互作形成蛋白质复合体,介导SINATs对ATG13的泛素化降解。深入研究表明,ATG13a蛋白质上18个丝氨酸和苏氨酸残基对于其磷酸化及自噬介导的营养缺陷抗性至关重要。进一步研究显示,14-3-3s蛋白与磷酸化ATG13a的互作增强,促进SINATs介导磷酸化ATG13泛素化降解,并抑制ATG1-ATG13激酶复合体的形成。与其生理功能一致,拟南芥14-3-3λ 14-3-3κ双突变体表现出延迟衰老、对营养缺陷的抗性增强及自噬体形成增多的表型。
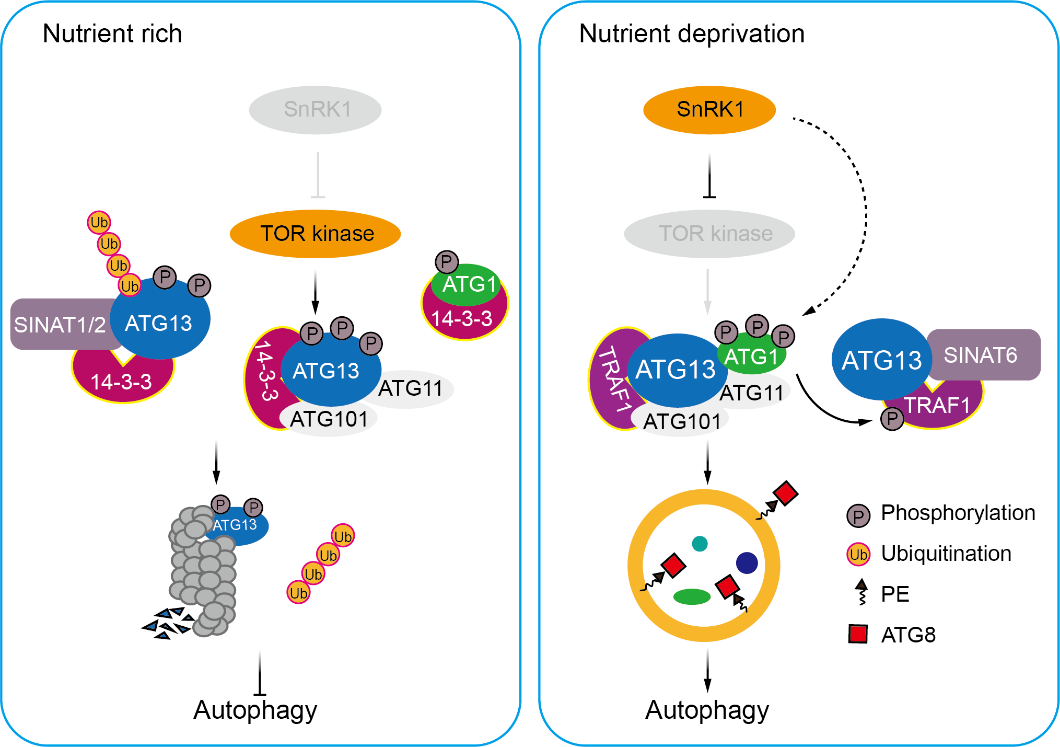
14-3-3蛋白调控植物自噬起始的模式图
该研究以“14-3-3 proteins contribute to autophagy by modulating SINAT-mediated degradation of ATG13”为题,于9月2日在国际权威期刊The Plant Cell在线发表。论文首次阐明了植物14-3-3λ和14-3-3κ促进SINAT家族蛋白通过介导磷酸化ATG13蛋白的泛素化修饰和稳定性,从而调控植物自噬起始的分子机制,具有重要的科学意义(Qi et al., Plant Cell, 2022)。
该论文研究受到国家杰出青年科学基金项目、国家自然科学基金青年科学基金项目、广东省重点领域研发计划项目、广东省自然科学基金面上项目和岭南现代农业科学与技术广东省实验室项目等资助。原特聘研究员齐华(现岭南现代农业科学与技术广东省实验室首聘教授)、毕业硕士生雷雪和在读博士生王瑶为论文的共同第一作者,肖仕教授为论文的独立通讯作者,香港中文大学姜里文教授和华南农业大学仇荣亮教授参与了该论文部分工作。
近年来,肖仕教授课题组在植物自噬的生理功能及自噬体形成机制研究中取得了系列研究成果,发现了自噬通过调控水杨酸介导的活性氧平衡,参与植物低氧应答的新功能(Chen et al., Autophagy, 2015);揭示了自噬通过调控过氧化物酶体稳定性及活性氧稳态,参与调控葡萄糖信号应答和植物根分生组织活性的分子机理(Huang et al., Autophagy, 2019);解析了TRAF1接头分子蛋白介导SINATs对ATG6和ATG13蛋白的泛素化和稳定性,动态调控植物自噬体形成的新机制(Qi et al., Plant Cell 2017; Qi et al., Plant Cell, 2020);阐明了植物自噬、蛋白酶体和液泡分选等蛋白质质量控制通路互作,通过影响关键蛋白FREE1和VPS23a稳定性,精细调控脱落酸信号转导的分子机理(Xia et al., Plant Cell, 2020)。这些研究成果为深入理解植物自噬的生物学功能及其调控机理提供了新证据和新视角,得到了国际同行的关注和认可,多篇论文获选重点推荐或ESI高被引论文。
参考文献:
1、Qi, H., Lei, X., Wang, Y., Yu, S., Liu, T., Zhou, S.K., Chen, J.Y., Chen, Q.F., Qiu, R.L., Jiang, L.W., and Xiao, S. (2022). 14-3-3 proteins contribute to autophagy by modulating SINAT-mediated ATG13 degradation. Plant Cell doi: 10.1093/plcell/koac273.
2、Chen, L., Liao, B., Qi, H., Xie, L.J., Huang, L., Tan, W.J., Zhai, N., Yuan, L.B., Zhou, Y., Yu, L.J., Chen, Q.F., Shu, W., and Xiao, S. (2015). Autophagy contributes to regulation of the hypoxia response during submergence in Arabidopsis thaliana. Autophagy 11: 2233–2246.
3、Huang, L., Yu, L.J., Zhang, X., Fan, B., Wang, F.Z., Dai, Y.S., Qi, H., Zhou, Y., Xie, L.J., and Xiao, S. (2019). Autophagy regulates glucose-mediated root meristem activity by modulating ROS production in Arabidopsis. Autophagy 15: 407–422.
4、Qi, H., Xia, F.N., Xie, L.J., Yu, L.J., Chen, Q.F., Zhuang, X.H., Wang, Q., Li, F., Jiang, L., Xie, Q., and Xiao, S. (2017). TRAF family proteins regulate autophagy dynamics by modulating AUTOPHAGY PROTEIN6 stability in Arabidopsis. Plant Cell 29: 890–911.
5、Qi, H., Li, J., Xia, F.N., Chen, J.Y., Lei, X, Han, M.Q., Xie, L.J., Zhou, Q.M., and Xiao, S. (2020). Arabidopsis SINAT Proteins Control Autophagy by Mediating Ubiquitylation and Degradation of ATG13. Plant Cell 32: 263–284.
6、Xia, F.N., Zeng, B., Liu, H.S., Qi, H., Xie, L.J., Yu, L.J., Chen, Q.F., Li, J.F., Chen, Y.Q., Jiang, L., and Xiao, S. (2020). SINAT E3 ubiquitin ligases mediate FREE1 and VPS23A degradation to modulate abscisic acid signaling. Plant Cell 32: 3290–3310.
作者
本院
来源
本院



