白菜官网黄军就教授课题组开发双AAV介导引导编辑器(Split-PE)在小鼠眼底实现精准基因编辑
CRISPR/Cas(Clustered regularly interspaced short palindromic repeats/ CRISPR-associated protein)系统是一种源于细菌和古细菌的抗病毒获得性免疫机制。CRISPR/Cas系统以RNA蛋白质复合体的形式发挥免疫作用,其中效应蛋白包括Cas9,Cas12a,Cas12b,CasX等。经科学家改造将crRNA和tracrRNA合二为一形成单链引导RNA(guide RNA,gRNA)。Cas蛋白首先识别基因组上的PAM(Protospacer adjacement motif)序列,然后gRNA 特异性识别并与靶位点互补配对,从而激活Cas蛋白发挥核酸内切酶的功能切割DNA双链,实现特定位点的基因编辑。自开发成为有效的基因编辑工具以来在各种生物体中得到了广泛的应用,来自化脓链球菌(Streptococcus pyogenes, Sp)的CRISPR/Cas9系统是其中应用最广泛的基因编辑工具。然而,由于人类遗传变异多为点突变、插入或缺失,而CRISPR/Cas9系统通过同源重组的方式实现精确的碱基修复的效率低下,且在修复过程中会导致双链损伤引发脱靶风险,限制了CRISPR/Cas9系统在精确的碱基修复领域的应用 (Science 2012; Science 2013; Cell 2017; Nature Biotechnology 2020)。
在Cas9 H840A切口酶(Cas9n-H840A切口酶)的C端融合逆转录酶,并在向导RNA(sgRNA)的基础上进行改造,使其包含一段诱导目标碱基突变的RT模板以及引物结合位点(primer binding site,PBS),从而构建得到引导编辑技术的向导RNA(prime editing guide RNA,pegRNA,获得目标Prime editing(PE)系统。PE系统通过pegRNA靶向基因组内特定位点,而被Cas9n-H840A切口酶切断的非互补链与pegRNA携带的PBS结构结合,在逆转录酶作用下,利用逆转录模板(RT template)进行修复,从而在靶位点实现特定碱基的转换、插入和缺失 (Nature 2019)。
但由于PE编辑系统的蛋白编码序列长达6.2kb,因此无法高效地装载到单个装载容量仅为4.7kb腺相关病毒(adeno-associated virus, AAV),进而限制其在体内治疗研究。因此克服AAV病毒的承载能力限制,体内呈递高活性的引导编辑器是目前亟待解决的难题 (Nature 2019; Nature Reviews Genetics 2020)。
为解决该难题,黄军就教授课题组将PE科学地拆分至两个不同的AAV上,通过内含肽(intein)使它们能在细胞内重新合并成全长具有功能的PE蛋白,构建双AAV介导的Split-PE系统。首先在体外成功筛选出具有高活性的Split-PE1024变体, 并通过双AAV8分别包装split-PE1024的N端和C端(分别带有pegRNA和gRNA),通过视网膜下腔注射在视网膜区域实现靶基因Dnmt1 (p.P55Q, c.G164T)的碱基颠换。通过深度测序检测靶位点的编辑效率,结果发现CMV启动子和EF1α核心启动子驱动的split-PE1024都成功在视网膜Dnmt1基因位点实现+5 G-to-T的碱基颠换。
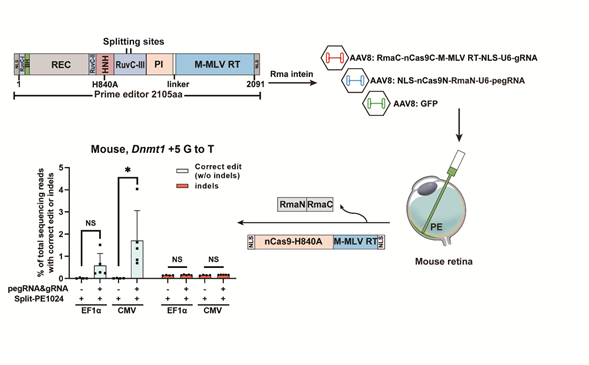
双AAV介导Split-PE1024诱导小鼠眼底视网膜点突变
研究成果“Dual-AAV delivering split prime editor system for in vivo genome editing”近期发表在Molecular Therapy杂志。该研究构建的双AAV介导的Split-PE系统成功在小鼠视网膜实现精准的体内编辑,为遗传病的体内治疗提供有效的工具。
600全讯白菜官方网站黄军就教授和梁普平副教授为该论文的共同通讯作者,博士生支胜尧和陈昱僖博士为论文共同第一作者。该研究得到国家重点研发计划、国家自然科学基金等项目资助。
原文链接: https://doi.org/10.1016/j.ymthe.2021.07.011
作者
本院
来源
本院



